El dímero de la COX-2 como nueva diana terapéutica contra el cáncer
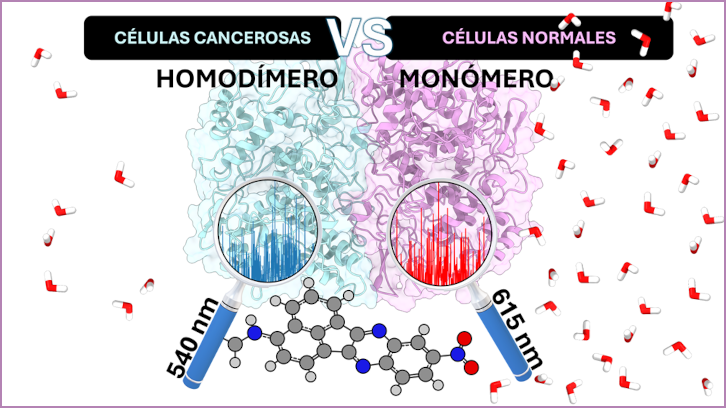
El grupo de investigación MolBioMed del Departamento de Química, en colaboración con la Universidad de Barcelona, ha publicado un artículo que demuestra la relación directa entre el dímero de la enzima COX-2 y el cáncer. El estudio computacional revela el diferente comportamiento del espectro de fluorescencia del compuesto NANQ-IMC6 al interaccionar con el monómero (presente en tejidos inflamados) y con el dímero (presente en células cancerosas).
La inflamación es un mecanismo de defensa clave contra lesiones y patógenos y resulta perjudicial cuando se cronifica, ya que favorece la destrucción de tejidos, la progresión del cáncer y la evasión inmune. Los mediadores proinflamatorios derivados del ácido araquidónico, como las prostaglandinas y los leucotrienos, producidos por las enzimas ciclooxigenasa-2 (COX-2) y 5-lipooxigenasa (5-LOX), impulsan la inflamación aguda, concretamente, la prostaglandina E2 de la COX-2 juega un papel crucial. Aunque los fármacos inhibidores de la COX-2, como los conocidos AINE, muestran potencial en la prevención del cáncer, su no selectividad o uso prolongado provoca graves efectos secundarios, lo que limita su uso.
Curiosamente, la COX-2 está sobreexpresada en los tejidos cancerosos y actúa como marcador de cáncer, lo que permite el uso de compuestos fluorogénicos como el NANQ-IMC6, que se dirigen selectivamente a la COX-2 y muestran una fluorescencia diferenciada en tejidos cancerosos e inflamatorios. La hipótesis de este trabajo es que la diferente respuesta se debe a la dimerización de la COX-2 (unión de dos unidades de la misma enzima) en tumores, abriendo nuevas estrategias para el diseño de fármacos selectivos que mitigan el crecimiento del cáncer inducido por la COX-2 sin efectos adversos. Este estudio utiliza técnicas avanzadas de simulación para explorar la base molecular de los cambios de fluorescencia inducidos por la dimerización, aportando luz sobre nuevas vías terapéuticas específicas contra el cáncer.
El estudio se centra en la descripción teórica del espectro de fluorescencia del ligando NANQ-IMC6 en las formas monoméricas y homodiméricas de la enzima humana COX-2 mediante las técnicas computacionales de docking molecular, dinámica molecular y simulaciones QM/MM (Mecánica Cuántica/Mecánica Molecular). Las simulaciones de dinámica molecular muestran un diferente comportamiento del ligando en las tres posibles cavidades de unión con la enzima, especialmente en la cavidad B del dímero de la COX-2, que es, sin lugar a duda, la responsable del cambio de comportamiento del espectro de fluorescencia. A partir de estructuras de estas dinámicas moleculares se han realizado simulaciones QM/MM en el estado excitado S1 del monómero y del homodímero, con la unidad NANQ incluida en la región QM. Después de estas simulaciones se ha podido construir el espectro de fluorescencia teórico del compuesto que muestra cómo el dímero tiene un desplazamiento energético de -75 nm respecto del compuesto en el monómero. Este valor es comparable con los observados experimentalmente entre tejidos cancerosos y tejidos inflamatorios.
Además, se ha podido observar que entre las dos unidades monoméricas presentes en el dímero existe una interacción alostérica que convierte nuestro sistema en un heterodímero funcional. Uno de los monómeros actúa sobre el otro de tal modo que permite un cambio conformacional en la otra cavidad, que, por lo que nos atañe, impide al ligando situarse por igual a ambos lados y modifica la fotoquímica de nuestro compuesto. Estudios recientes demuestran experimentalmente que el comportamiento de cada una de las unidades del dímero no es igual siempre (por eso el concepto heterodímero). Nuestros resultados verifican la posible implicación moduladora de una de las unidades en formarse el dímero.
En conclusión, los resultados muestran que la COX-2 sobreexpresada en tejidos cancerosos existe como dímero, mientras que en lesiones inflamatorias se presenta como monómero. Esto abre la puerta a diseñar nuevos medicamentos antiinflamatorios que inhiban selectivamente al homodímero de COX-2 para tratar el cáncer con menos efectos secundarios.
Departamento de Química
Grupo de Investigación MolBioMed (Molecular Biomedicine)
Universitat Autònoma de Barcelona
Referencias
Pérez-Sánchez, Á.; Curutchet, C.; González-Lafont, À.; José M. Lluch. First-principles simulations of the fluorescence modulation of a COX-2 specific fluorogenic probe upon protein dimerization for cancer discrimination. Protein Science 2025, 43 (1), e70001. DOI: http://dx.doi.org/10.1002/pro.70001


