Un estudio en colaboración con el Sincrotrón ALBA prueba la ineficacia de algunos fármacos contra la diabetes
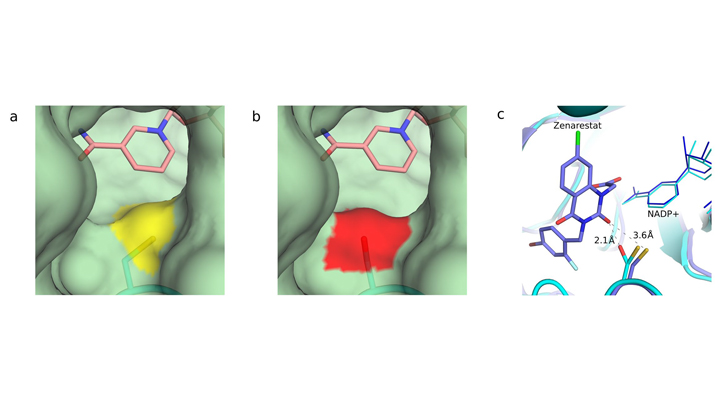
Figura 1. Cambios en el canal de entrada al centro de unión de la aldosa reductasa. La conversión de la cisteína en serina modifica la entrada del sustrato (la glucosa). a) Entrada del centro de unión de la forma nativa de la aldosa reductasa. El átomo de azufre de la cisteína está marcado en amarillo. b) Entrada del centro de unión de la proteína irradiada, que muestra la serina en rojo. En ambos casos, el anillo de nicotinamida del cofactor involucrado se indica en color rosa. c) Colisiones estéricas de la aldosa reductasa activada con uno de los fármacos probados: el Zenarestat. El inhibidor, diseñado contra la forma nativa, muestra colisiones severas con la serina pero no con la cisteína.
La aldosa reductasa es una proteína que se estudia desde los años 80 y ya hace tiempo que se conoce su relación con la diabetes. Ahora, los investigadores Xavier Parés y Jaume Farrés, en colaboración con el equipo del Sincrotrón ALBA, han demostrado por qué algunos de los fármacos que se están desarrollando para tratar los efectos de la diabetes no funcionan en el intento de bloquear la aldosa reductasa. Los resultados de esta investigación se han publicado en la revista Scientific Reports.
En general, la proteína tiene funciones detoxificantes en la célula pero también es capaz de transformar la glucosa en una molécula llamada sorbitol. En situaciones de hiperglucemia (altos niveles de glucosa en sangre), esta reacción se da mucho más y el sorbitol se acumula, consumiendo las reservas de antioxidantes. Si la situación de hiperglucemia se cronifica – como en el caso de diabetes –, provoca una serie de desequilibrios dentro la célula que llevan a un estrés oxidativo perjudicial.
Para evitar esta situación, se necesitaría un fármaco que inhibiese la actividad de la aldosa reductasa para reducir la presencia de sorbitol. El objetivo es que el fármaco se una a la proteína y ocupe el sitio de enlace que correspondría a la glucosa. Así, se detendría desde el inicio la reacción química que conduce al estrés oxidativo.
Sin embargo, aún no se han creado fármacos efectivos para combatir la proteína y en los ensayos clínicos no funcionan como sería deseable. “La cuestión es que la aldosa reductasa puede presentar dos formas diferentes, la nativa original y la activada. Debido al estrés oxidativo que hay en condiciones de diabetes, cambia de forma y aparece la variante activada” explica Isidro Crespo, estudiante de doctorado del Sincrotrón. Aunque se conoce este cambio en la estructura de la proteína, se siguen diseñando fármacos teniendo en cuenta la forma original, en vez de la activada. Los resultados obtenidos por el equipo muestran en detalle cómo cambia la proteína bajo los efectos del estrés oxidativo y, más importante, cómo estos cambios afectan a la eficacia de los fármacos.
La línea de luz XALOC del Sincrotrón ALBA permite determinar qué estructura tridimensional tienen las proteínas. En este estudio, además, también han aprovechado la luz de sincrotrón, principalmente formada per rayos X de alta energía, para producir daños a la proteína. “Hemos visto que, irradiando la aldosa reductasa con la luz del Sincrotrón, podemos provocar los mismos efectos que los que sufre la proteína bajo el estrés oxidativo de las células de personas con diabetes” comenta Albert Castellví, investigador del equipo. “Conseguimos convertir la forma nativa de la proteína en otra que se comporta igual que la forma activada real que tienen los pacientes diabéticos” añade.
Una vez obtenida esta forma activada, han probado fármacos que ya habían sido descartados en los ensayos clínicos y han corroborado que no son efectivos. Concluyen que se debe al cambio de estructura que ha padecido la proteína a causa de la irradiación con los rayos X del Sincrotrón. Bajo condiciones de estrés oxidativo, la conversión de tan solo un aminoácido de la proteína original (una cisteína) en otros aminoácidos (mayoritariamente serina o alanina) afecta la unión del fármaco inhibidor a la proteína y explica el cambio de comportamiento de los fármacos. Para que el fármaco sea efectivo, es imprescindible que encaje en la aldosa reductasa como si de una pieza de puzle se tratara. Si la proteína cambia de forma, el fármaco no encajará bien. Para los investigadores, este hecho causa la ineficacia de los fármacos de la diabetes y proponen una nueva vía en el desarrollo de fármacos: diseñarlos de modo que encajen en la forma cambiada, la activada, para bloquearla totalmente.
La alta complejidad del estrés oxidativo y la diversidad de factores que lo provocan hacen que no se pueda reproducir in vitro. “Por este motivo el método con luz de sincrotrón es de gran utilidad para inducir y estudiar los cambios que tiene la aldosa reductasa en las condiciones de estrés oxidativo derivadas de la diabetes”, resalta Judith Juanhuix, investigadora y responsable de este estudio. Este método, de hecho, es generalizable y se podría extender al estudio de otras proteínas que ven modificada su estructura bajo estrés oxidativo y que son relevantes en enfermedades como el Parkinson, el cáncer o el Alzheimer.
Universitat Autònoma de Barcelona
Referencias
Castellví A, Crespo I, Crosas E, Cámara-Artigas A, Gavira JA, Aranda MAG, Parés X, Farrés J, Juanhuix J. (2019). Efficacy of aldose reductase inhibitors is affected by oxidative stress induced under X-ray irradiation. Sci Rep, 9(1):3177. DOI: 10.1038/s41598-019-39722-0.


