Identifican un nuevo mecanismo de regulación de las proteínas
26/11/2018
El control del tiempo de vida de las proteínas celulares es un mecanismo esencial para regular su actividad y para que funcione correctamente el ciclo celular. Este ciclo permite que las células puedan dividirse y así hacer que los tejidos crezcan y se regeneren. El control de las diferentes etapas del ciclo celular está ejercido por diferentes tipos de proteínas que se van sustituyendo a medida que avanza el ciclo. Las células han diseñado un mecanismo para marcar las proteínas que deben sustituirse para ser destruidas, este proceso se denomina ubiquitinación, y la marca consiste en la formación de una cadena con la proteína ubiquitina. Las proteínas marcadas (con ubiquitina) son eliminadas por una especie de gran desechería celular llamada proteosoma que se encarga de triturarlas. La regulación de este proceso es muy importante para que el ciclo celular funcione correctamente, de lo contrario puede conllevar alteraciones en la proliferación celular que podrían conducir a procesos cancerígenos, donde los tejidos crecen sin control.
En el trabajo que los investigadores acaban de publicar en la revista Nature Communications presentan la caracterización estructural y el descubrimiento de un nuevo mecanismo de regulación de una enzima que corta las cadenas de ubiquitina, llamada USP25. Esta enzima elimina las cadenas de ubiquitina de las proteínas marcadas y tiene un impacto importante en su función celular al evitar que sean degradadas por el proteosoma.
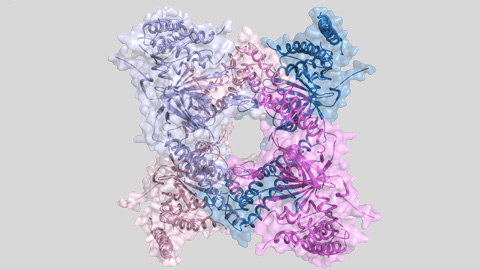
La estructura tridimensional de esta enzima, obtenida gracias a la cristalografía de proteínas y a la luz del sincrotrón ALBA, ha permitido observar la presencia de un ensamblaje proteico con dos tipos diferentes de estructura cuaternaria: tetrámero y dímero. Y lo que es más importante, el tetrámero es inactivo y el dímero es activo. Por lo tanto la alternancia entre estos dos ensamblajes regula la actividad de esta enzima y, de rebote, el tiempo de vida de importantes proteínas celulares.
El estudio se ha realizado en el laboratorio del Dr. David Reverter, que dirige el grupo de estructura de proteínas del Instituto de Biotecnología y Biomedicina de la UAB (IBB), y también ha colaborado el grupo de la Dra. Virginia Amador, del centro de investigación biomédica IDIBAPS, en el Hospital Clínico. El primer autor del trabajo ha sido el Dr. Bing Liu, vinculado también al IBB y al Departamento de Bioquímica y Biología Molecular de la UAB.
Referencia:
Liu, B., Surena-Gomez, M., Zhen, Y., Amador, V., Reverter, D. A quaternary tetramer assembly inhibits the deubiquitinating activity of USP25. Nature Communications (2018). DOI: 10.1038/s41467-018-07510-5.