Microscopia Óptica (OM)
La creación del primer microscopio simple por Anton von Leeuwenhoek a finales de 1600 supuso una revolución a nivel científico, ya que permitió adentrarse en un mundo microscópico hasta entonces inexplorado. Desde ese momento, los microscopios ópticos han evolucionado extremadamente y han surgido nuevas tecnologías. Esta enorme evolución tecnológica ha hecho que la microscopía óptica no se haya quedado atrás y siga siendo igual de necesaria, permitiendo estudios de gran interés científico.
El área de OM ofrece laboratorios con campanas de flujo laminar vertical, incubadora, baño María, autoclave, así como centrífugas y material fungible para montar las muestras.
El personal del área también brinda asesoramiento científico-técnico para optimizar y/o diseñar experimentos, así como para desarrollar nuevas aplicaciones. Además, ofrece entrenamiento a los usuarios que deseen utilizar el equipo en régimen de autoservicio.
Servicios
Adquisición de imágenes de fluorescencia con cámara.

El microscopio estereoscópico permite la observación de muestras voluminosas ya sea con luz transmitida, reflejada, polarizada o por fluorescencia.
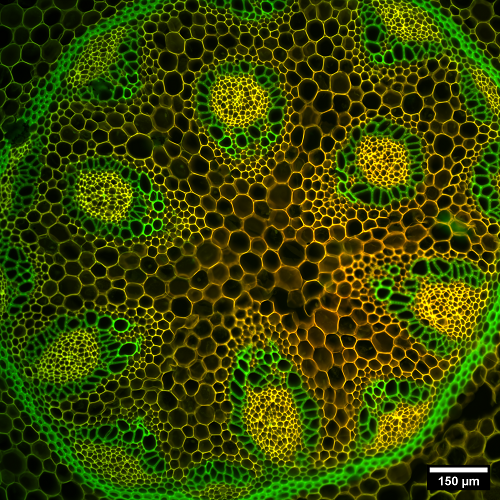
La observación de muestras por confocal permite la obtención de imágenes con alto nivel de contraste y nitidez.
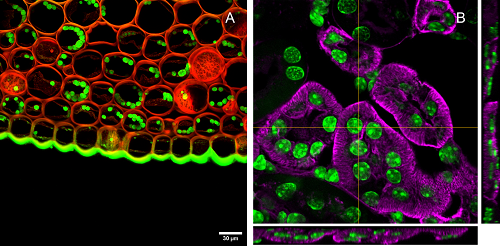
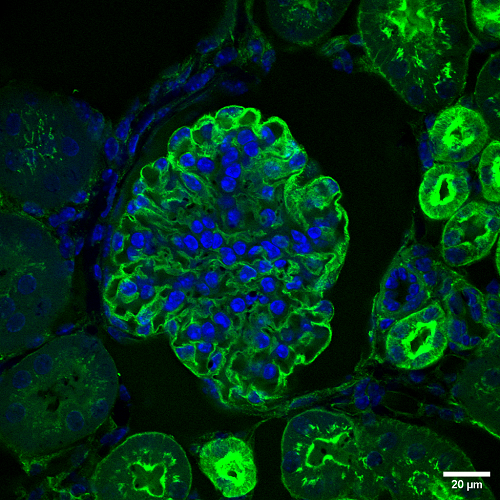
Gracias al pinhole, el confocal permite captar únicamente la luz que proviene del plano que está enfocado, de manera que se pueden generar secciones ópticas para obtener la información en volumen. Este tipo de captaciones es útil tanto para demostrar la posición relativa de estructuras como para realizar una reconstrucción tridimensional posterior. Esta reconstrucción puede tener una finalidad cualitativa o cuantitativa.
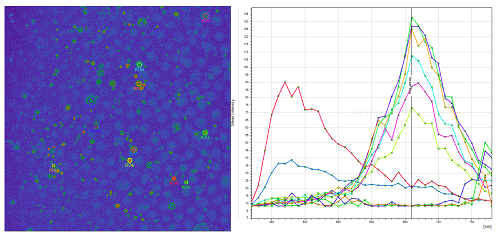
El confocal permite analizar la emisión de la muestra para extraer su espectro idiosincrático. Este tipo de adquisición permite la caracterización de autofluorescencias, el análisis de cambios en la emisión, etc.
Captaciones de un plano o de un volumen en el tiempo que permiten el estudio de dinámicas celulares o de orgánulos. Es muy importante que el usuario tenga conocimiento de la escala temporal en la que ocurre el evento para poder ajustar el equipo.
Las captaciones temporales permiten el estudio de dinámicas iónicas. Es muy importante que el usuario tenga conocimiento de la escala temporal en la que ocurre el evento para poder ajustar el equipo.
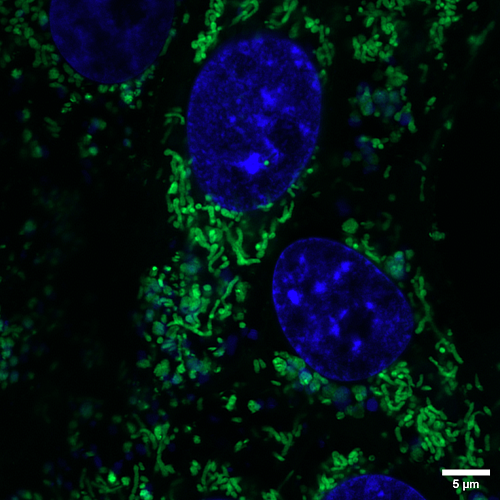
Adquisición de imágenes de fluorescencia con alta resolución gracias al módulo de Airyscan, que permite alcanzar una resolución lateral de 120 nm y axial de 350 nm (dependiendo de la muestra).
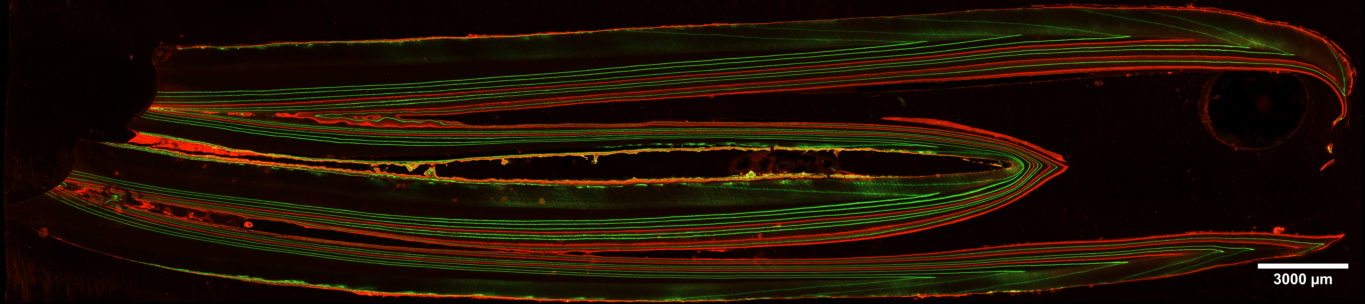
Dos de los confocales de los que dispone el SMiDRX están equipados con platinas motorizadas que permiten cartografiar las muestras. A partir de unas coordenadas, el equipo captará automáticamente toda el área definida. Por otro lado, las platinas motorizadas también permiten definir puntos de interés (coordenadas) en la muestra y poder recuperarlos.
FLIM (Fluorescence Lifetime Imaging Microscopy): Esta técnica permite obtener una imagen basada no en el espectro de emisión ni en la intensidad del fluoróforo, sino en las diferencias en el tiempo de vida media de cada uno. Esta técnica es especialmente útil para poder distinguir un marcaje específico en una muestra que sea muy autofluorescente en el mismo rango de emisión.
FRET (Förster Resonance Energy Transfer): Es un mecanismo que permite describir la energía transferida entre dos moléculas sensibles a la luz. Un fluoróforo donador, cuando se excita con una fuente de luz, es capaz de transferir su energía a un fluoróforo aceptor. La eficiencia de esta transferencia de energía depende de la distancia entre estas dos moléculas, haciéndola muy sensible a pequeños cambios. Por tanto, estas medidas de FRET pueden ser utilizadas para estudiar interacciones entre proteínas, para medir fluidez de membranas, para estudios de vías de señalización, entre otros.
FCS (Fluorescence Correlation Spectroscopy): Es el análisis de la correlación de las fluctuaciones en las intensidades de fluorescencia. Una de las aplicaciones más interesantes de este análisis es el cálculo de las fluctuaciones de concentración de moléculas fluorescentes en suspensión.
Anisotropía: Es el fenómeno donde la luz emitida por un fluoróforo tiene diferentes intensidades a lo largo de los diferentes ejes de polarización. Esta técnica puede ser utilizada para medir cinéticas de reacciones que causan un cambio en la rotación de las moléculas.
FRAP (Fluorescence Recovery After Photobleaching): Es una técnica utilizada para estudiar la movilidad de moléculas a través de células vivas o tejidos. Es especialmente útil en estudios biológicos de difusión de proteínas y moléculas lipídicas individuales a través de membranas celulares.
Fotoactivación y Fotoconversión: Estos dos procesos permiten hacer un seguimiento del movimiento y el comportamiento de diversas proteínas dentro de la célula o de diversas células dentro de un tejido. Son muy útiles en el ámbito, sobre todo, de la biología celular, por ejemplo, en estudios de dinámica mitocondrial en células vivas.
TIRFM permite obtener imágenes con una elevada resolución axial, de alrededor de 100 nm, y debido a su rango de trabajo, permite el estudio de procesos asociados a la membrana.
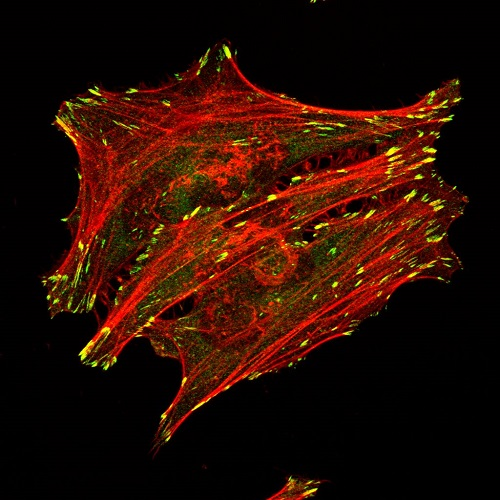
Realización de inmunomarcajes en células y tejidos. Los anticuerpos primarios serán proporcionados por los usuarios.
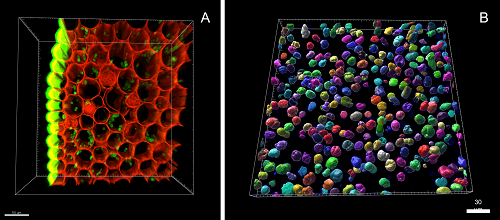
Mediante diferentes programas de imagen se puede realizar el procesamiento de imágenes captadas con los equipos para mejorar la imagen original o ajustarla para presentarla de manera óptima. También hay programas disponibles para el análisis y cuantificación para obtener información cuantitativa de las muestras.