Nou article: "Surpassing protein specificity in biomimetics of bacterial amyloids"
Grup de recerca: Nanobiotecnologia
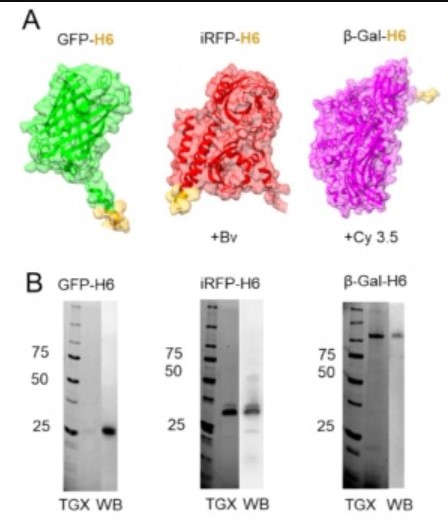
A la natura, els amiloides proteics no tòxics serveixen com a dipòsits dinàmics i específics de proteïnes, exemplificats tant per cossos d'inclusió bacteriana com per grànuls secretors del sistema endocrí. Inspirats en aquests sistemes, s'han desenvolupat microgrànuls de proteïnes artificials definits químicament i que compleixen la normativa per a aplicacions clíniques com a dipòsits de proteïnes semblants a les endocrines. Això s'ha aconseguit aprofitant la coordinació reversible entre residus d'histidina i cations divalents com Zn+2, que afavoreix les interaccions proteïna-proteïna. Tot i que l'estereespecificitat és una característica arquitectònica principal dels amiloides naturals, el potencial dels enfocaments sintètics per crear materials proteics híbrids segueix sense explorar. Aquests materials podrien permetre l'aparició i l'aplicació local sincronitzada de diverses proteïnes en proporcions molars predefinides, per a reaccions enzimàtiques acoblades o el lliurament de polipèptids d'acció sinèrgica. Aquí, informem sobre la fabricació de grànuls de proteïnes artificials amb arquitectura amiloïdal formada mitjançant la combinació de dos polipèptids estructuralment diferents. Concretament, vam provar la co-agregació dels parells GFP/IRFP i GFP/β-galactosidasa. La formació de micropartícules híbrides es va confirmar mitjançant FRET i metodologies complementàries, demostrant que la tecnologia de agrupació His-Zn no requereix homologies seqüencials o estructurals entre polipèptids agregats. Aquest enfocament obre noves vies per al desenvolupament de dipòsits funcionals que aprofitin les funcionalitats de proteïnes sinèrgiques, obrint el camí per a materials funcionals de nova generació.
Dades article:
International Journal of Biological Macromolecules, 2025, online
https://www.sciencedirect.com/science/article/abs/pii/S0141813025001849?via%3Dihub
