Biologia Sintètica
Línies de Recerca
Mitjançant eines d’enginyeria genètica, modifiquem el genoma de diferents bacteris amb finalitats terapèutiques. Tenim diferents projectes enfocats en diferents bacteris (Mycoplasma pneumoniae, Lactobacillus, Brucella) i diferents aplicacions (càncer de pulmó, glioblastoma, vacunes). El nostre grup té un component “translacional” molt potent al incorporar Pulmobiotics, “start up” que vam fundar al 2020 resultat de la recerca realitzada al Centre de Regulació Genòmica.
1. Enginyeria de Mycoplasma pneumoniae pel tractament de malalties respiratòries (PULMOBIOTICS).
Mitjançant eines de biologia sintètiques desenvolupades i patentades, Pulmobiotics va deleccionar gens virulents en M. pneumoniae, obtenint una soca atenuada coneguda com a MycoChassis. Aquest MycoChassis és la base on es afegeixen nous gens per dissenyar tractaments per malalties respiratòries.
Projectes: PB_LC, MycoMatrix, PB_VAP, LactAS
2. Desenvolupament d'eines d'enginyeria molecular en altres bacteris com Lactobacillus i Brucella.
Projectes: BruPatho, VENUS, Lac2Brain
BruPatho: Patogènesis placentària de brucella i desenvolupament de noves vacunes desde una nova perspectiva molecular en brucel·losis
Aquest projecte, finançat a la convocatòria PID2022 «Proyectos de Generación de Conocimiento», té com a objectiu estudiar els mecanismes moleculars implicats en la patogènesi de Brucella utilitzant tecnologies de biologia de sistemes de darrera generació i aplicar els coneixements generats per desenvolupar candidats a vacunes contra B. suis. Aquests estudis es basen en resultats previs del grup de la nostra col.laboradora Professora Maria Jesús Grillo (IDAB-CSIC), que tracten sobre la patogènesi placentària de B. melitensis i B. suis, així com la dissociació espontània in vivo de B. suis bv2, juntament amb els enfocaments moleculars innovadors que ha utilitzat amb èxit el nostre grup en Mycoplasma pneumoniae.

VENUS: El microbioma vaginal com a model per l'estudi de proteïnes petites (SEPs)
Restablir la disbiosi del microbioma mitjançant l’enriquiment amb bacteris probiòtics s’utilitza actualment per tractar malalties infeccioses. No obstant això, aquests tractaments sovint són ineficaços, especialment en presència de biofilms formats per bacteris patògens. La biologia sintètica pot obrir el camí per dissenyar bacteris com a “xassís” per eliminar biofilms. Tanmateix, encara s’ha d’entendre l’impacte d’aquests xassís i la seva aplicabilitat per estudiar l’homeòstasi dels microbiomes.
El projecte del microbioma humà (HMB) va permetre la identificació massiva de genomes microbians presents en diferents òrgans humans. Aquests estudis principalment van anotar ORFs que codifiquen proteïnes grans (>100aa) o de menors però conservades. Hem descobert que, de mitjana, un 16% del genoma bacterià podria codificar pèptids petits (SEPs; <100aa), alguns d’ells essencials i/o implicats en la infecció i la detecció de quòrum. Per tant, els SEPs bacterians podrien ser importants per controlar els diferents microbiomes humans, assegurant la coexistència i prevenint infeccions. No obstant això, la identificació de SEPs en ecosistemes microbians i l’estudi dels seus rols en l’homeòstasi no és senzill.
A VENUS, abordarem aquests reptes utilitzant l’ecosistema vaginal a causa de la seva accessibilitat, els models animals disponibles i la seva rellevància per a la salut. Primer, utilitzarem un programari desenvolupat per nosaltres, RanSEPs, per identificar els SEPs secretats en el tracte reproductiu femení (FRT). Segon, després de mimetitzar in vitro l’ecosistema vaginal, caracteritzarem experimentalment la funció dels SEPs secretats i seleccionarem aquells amb activitat antimicrobiana o de detecció de quòrum per dissenyar racionalment diferents xassís bacterians basats en bacteris trobats en el tracte genital, amb activitat de dispersió de biofilms i de modulació de l’homeòstasi. Finalment, avaluarem in vitro i en un model de ratolí in vivo l’impacte de les soques modificades en l’homeòstasi del microbioma i la degradació del biofilm de S. aureus.
VENUS abordarà conceptes importants en la Biologia de Sistemes proporcionant una comprensió del paper dels SEPs en les complexes xarxes reguladores que orquestren l’homeòstasi dels microbiomes i utilitzarà la Biologia Sintètica per traduir aquest coneixement en el disseny de noves aproximacions terapèutiques. Projecte finançat a la Convocatoria 2023 «Europa Excelencia».
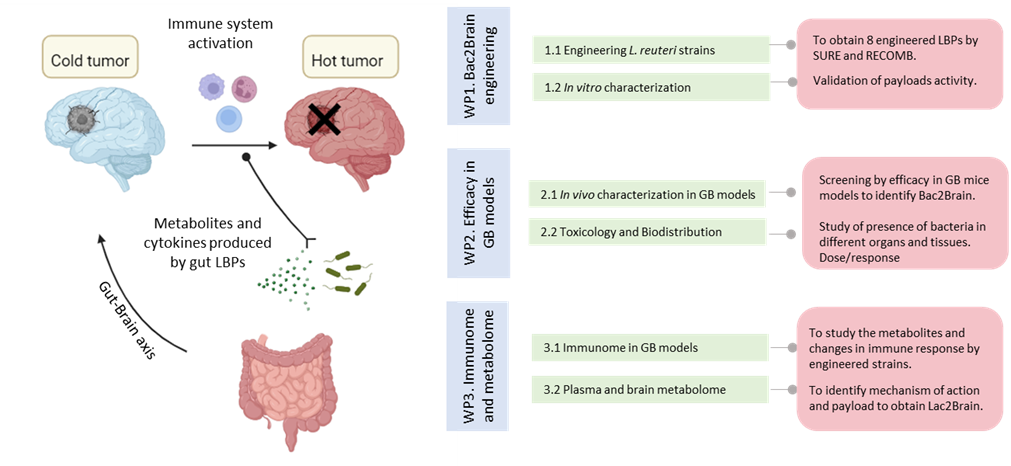
Lac2Brain: Enginyeria de bacteris de la microbiota intestinal pel tractament del glioblastoma
Tot i que la immunoteràpia ha estat transformadora en el tractament d'alguns càncers, les malignitats cerebrals mostren taxes de supervivència inalterables. En particular, el glioblastoma (GB) és el tumor cerebral primari més prevalent i agressiu, amb una supervivència mitjana de 14 mesos.
El microbioma intestinal és un modulador clau de la salut, fins i tot per a afeccions neurològiques. De fet, hi ha una forta interconnexió entre l'intestí i el cervell a través d'una xarxa bidireccional coneguda com l'eix intestí-cervell. A més, hi ha evidències creixents que vinculen el metabolisme del microbioma amb el pronòstic de diferents tipus de càncer, però cap d'aquests estudis ha analitzat el paper del microbioma en el càncer cerebral. Finalment, els bacteris tenen una capacitat natural per colonitzar i proliferar dins dels tumors.
Recentment hem implementat una caixa d'eines per modificar el genoma de una soca probiòtica de Lactobacillus ben coneguda que habita de manera natural en el tracte gastrointestinal. En aquest projecte, pretenem dissenyar aquet bacteri perquè secreti diferents metabòlits bacterians i citocines coneguts per augmentar la resposta immune dins del microambient tumoral. Després de l'administració oral dels bacteris, aquestes molècules seran secretades i translocades a través de l'eix intestí-cervell fins al cervell, on exerciran el seu efecte terapèutic recuperant l'eficàcia de la immunoteràpia.
A Lac2Brain, utilitzant enfocaments de "òmica" i models de ratolí in vivo, estudiarem l'eficàcia, el mecanisme d'acció i el potencial clínic d’aquets tractament. El coneixement obtingut en aquesta proposta podria expandir-se en el futur per tractar diferents malalties complexes del cervell. Projecte finançat a la convocatòria AECC LAB 2024.
Informació d'interès
MyLC: Mycoplasma pneumoniae as minimal lung bacterial chassis to deliver locally therapeutic proteins for the treatment of non-small cell lung carcinoma. (LC240083). Lluch Senar, M. (Investigadora principal). FY24 Lung Cancer Research program (LCRP). Financiada per: Congressionally Directed Medical Research Programs (CDMRP). Department of Defence, USA. Execució: 2025-2027.
Patogenesis placentaria de brucella y desarrollo de vacunas desde una nueva Perspectiva molecular en brucelosis (BruPatho). (PID2022-139200OB-C22). Financiada per: Ministerio de Ciencia, Innovación e Universitat. Execució: 2023-2026.
El microbioma vaginal como modelo para el estudio de las proteínas pequeñas (SEPs) (EUR2023-143461). Financiada per: Ministerio de Ciencia e Innovación. Execució: 2022-2025.
Lac2Brain: Engineering bacteria from gut microbiota for the treatment of glioblastoma (LABAE247377LLUC). Financiada per: AECC. Convocatoria para consolidar grupos emergentes AECC lab. Execució: 2024-2027.
AYUDAS PARA CONTRATOS TORRES QUEVEDO 2020 : Estudio del potencial preclínico del primer bioterapéutico recombinante respiratorio para el tratamiento del enfisema pulmonar y la neumonía asociada a ventilación (PTQ2020-011049). Financiada per: Ministerio de Ciencia e Innovación. Execució: 2021-2024.
AYUDAS PARA CONTRATOS TORRES QUEVEDO 2020 : Ingeniería y desarrollo de un nuevo pulmobioterapéutico para el tratamiento del cáncer de pulmón (PTQ2020-011048). Financiada per: Ministerio de Ciencia e Innovación. Execució: 2021-2024. PULMOBIOTICS.
LactAs: desarrollo de un bioterapéutico vivo recombinante para el tratamiento del asma grave (CPP2021-008552: Proyecto de Colaboración Público-Privada Retos Colaboración). Financiada per: Ministerio de Ciencia e Innovación. Execució: 2022-2025. PULMOBIOTICS.
CLINICAL READINESS OF A LIVE BIOTHERAPEUTIC FOR TREATMENT OF NON-SMALL CELL LUNG CANCER (Grant agreement ID: 101098475). Financiada per: The European Innovation Council (EIC) HORIZON.3.1.Execució: 1 January 2023 a 30 June 2025. Més informació a la web de Pulmobiotics. PULMOBIOTICS.
MycoMatrix: engineering of a recombinant live biotherapeutic to normalise tumour extracellular matrix in KRAS-driven Non-Small Cell Lung Cancer (CPP2022-009780: Proyecto de Colaboración Público-Privada Retos Colaboración). Financiada per: Ministerio de Ciencia, Innovación e Universitat. Execució: 2023-2026. PULMOBIOTICS.
NEOTEC 2021 (SNEO-20211019) - PLAN DE EMPRESA DE PULMOBIOTICS S.L. Financiada per: Centro para el Desarrollo Tecnológico Industrial (CDTI). Execució: 2022-2023. Més infomació a la web de Pulmobiotics. PULMOBIOTICS
Broto A, Piñero-Lambea C, Segura-Morales C, Tio-Gillen AP, Unger WWJ, Burgos R, Mazzolini R, Miravet-Verde S, Jacobs BC, Casas J, Huizinga R, Lluch-Senar M, Serrano L. Engineering Mycoplasma pneumoniae to bypass the association with Guillain-Barré syndrome. Microbes Infect. 2024 Jul-Aug;26(5-6):105342. doi: 10.1016/j.micinf.2024.105342. Epub 2024 Apr 26. PMID: 38679229; PMCID: PMC11234194.
Miravet-Verde S, Mazzolini R, Segura-Morales C, Broto A, Lluch-Senar M, Serrano L. Author Correction: ProTInSeq: transposon insertion tracking by ultra-deep DNA sequencing to identify translated large and small ORFs. Nat Commun. 2024 Mar 27;15(1):2680. doi: 10.1038/s41467-024-47153-3. Erratum for: Nat Commun. 2024 Mar 7;15(1):2091. PMID: 38538589; PMCID: PMC10973512.
Lluch-Senar M. From science to business: translating live biotherapeutic products to the clinic. Nat Rev Bioeng. 2023 Jun 2:1-2. doi:10.1038/s44222-023-00078-w. Epub ahead of print. PMID: 37359770; PMCID:PMC10236387.
Mazzolini R, Rodríguez-Arce I, Fernández-Barat L, Piñero-Lambea C, Garrido V, Rebollada-Merino A, Motos A, Torres A, Grilló MJ, Serrano L, Lluch-Senar M. Engineered live bacteria suppress Pseudomonas aeruginosa infection in mouse lung and dissolve endotracheal-tube biofilms. Nat Biotechnol. 2023 Aug;41(8):1089-1098. doi: 10.1038/s41587-022-01584-9. Epub 2023 Jan 19. PMID: 36658340; PMCID: PMC10421741.
Burgos R, Garcia-Ramallo E, Shaw D, Lluch-Senar M, Serrano L. Development of a Serum-Free Medium To Aid Large-Scale Production of Mycoplasma-Based Therapies. Microbiol Spectr. 2023 Jun 15;11(3):e0485922. doi: 10.1128/spectrum.04859-22. Epub 2023 Apr 25. PMID: 37097155; PMCID: PMC10269708.
Montero-Blay A, Blanco JD, Rodriguez-Arce I, Lastrucci C, Piñero-Lambea C, Lluch-Senar M, Serrano L. Bacterial expression of a designed single-chain IL-10 prevents severe lung inflammation. Mol Syst Biol. 2023 Jan;19(1):e11037. doi: 10.15252/msb.202211037. Epub 2023 Jan 4. Erratum in: Mol Syst Biol. 2024 Mar;20(3):291-292. PMID: 36598022; PMCID: PMC9834763.
Piñero-Lambea C, Garcia-Ramallo E, Miravet-Verde S, Burgos R, Scarpa M, Serrano L, Lluch-Senar M. SURE editing: combining oligo-recombineering and programmable insertion/deletion of selection markers to efficiently edit the Mycoplasma pneumoniae genome. Nucleic Acids Res. 2022 Dec 9;50(22):e127. doi: 10.1093/nar/gkac836. PMID: 36215032; PMCID: PMC9825166.
Garrido V, Piñero-Lambea C, Rodriguez-Arce I, Paetzold B, Ferrar T, Weber M, Garcia-Ramallo E, Gallo C, Collantes M, Peñuelas I, Serrano L, Grilló MJ, Lluch-Senar M. Engineering a genome-reduced bacterium to eliminate Staphylococcus aureus biofilms in vivo. Mol Syst Biol. 2021 Oct;17(10):e10145. doi: 10.15252/msb.202010145. PMID: 34612607; PMCID: PMC8493563.
Shaw D, Miravet-Verde S, Piñero-Lambea C, Serrano L, Lluch-Senar M. LoxTnSeq: random transposon insertions combined with cre/lox recombination and counterselection to generate large random genome reductions. Microb Biotechnol. 2021 Nov;14(6):2403-2419. doi: 10.1111/1751-7915.13714. Epub 2020 Dec 16. PMID: 33325626; PMCID: PMC8601177.
Burgos R, Weber M, Martinez S, Lluch-Senar M, Serrano L. Protein quality control and regulated proteolysis in the genome-reduced organism Mycoplasma pneumoniae. Mol Syst Biol. 2020 Dec;16(12):e9530. doi: 10.15252/msb.20209530. PMID: 33320415; PMCID: PMC7737663.
Miravet-Verde S, Burgos R, Delgado J, Lluch-Senar M, Serrano L. FASTQINS and ANUBIS: two bioinformatic tools to explore facts and artifacts in transposon sequencing and essentiality studies. Nucleic Acids Res. 2020 Sep 25;48(17):e102. doi: 10.1093/nar/gkaa679. PMID: 32813015; PMCID: PMC7515713.
Piñero-Lambea C, Garcia-Ramallo E, Martinez S, Delgado J, Serrano L, Lluch-Senar M. <i>Mycoplasma pneumoniae</i> Genome Editing Based on Oligo Recombineering and Cas9-Mediated Counterselection. ACS Synth Biol. 2020 Jul 17;9(7):1693-1704. doi: 10.1021/acssynbio.0c00022. Epub 2020 Jun 22. PMID: 32502342; PMCID: PMC7372593.
Montero-Blay A, Miravet-Verde S, Lluch-Senar M, Piñero-Lambea C, Serrano L. SynMyco transposon: engineering transposon vectors for efficient transformation of minimal genomes. DNA Res. 2019 Aug 1;26(4):327-339. doi: 10.1093/dnares/dsz012. PMID: 31257417; PMCID: PMC6704405.
Miravet-Verde S, Ferrar T, Espadas-García G, Mazzolini R, Gharrab A, Sabido E, Serrano L, Lluch-Senar M. Unraveling the hidden universe of small proteins in bacterial genomes. Mol Syst Biol. 2019 Feb 22;15(2):e8290. doi: 10.15252/msb.20188290. PMID: 30796087; PMCID: PMC6385055.
Lluch-Senar M, Delgado J, Chen WH, Lloréns-Rico V, O'Reilly FJ, Wodke JA, Unal EB, Yus E, Martínez S, Nichols RJ, Ferrar T, Vivancos A, Schmeisky A, Stülke J, van Noort V, Gavin AC, Bork P, Serrano L. Defining a minimal cell: essentiality of small ORFs and ncRNAs in a genome-reduced bacterium. Mol Syst Biol. 2015 Jan 21;11(1):780. doi: 10.15252/msb.20145558. PMID: 25609650; PMCID: PMC4332154.
Finançament
Informació complementària







